El Gobierno del presidente Gustavo Petro reconoció el desabastecimiento de medicamentos pediátricos con el VHI, por lo que tanto el Ministerio de Salud como el Instituto de Vigilancia de Medicamentos y Alimentos, INVIMA, explicaron lo que está sucediendo.
En principio informaron que se ha adelantado el análisis de disponibilidad de los mismos, definiendo los estados de disponibilidad a corte del 01 de enero de 2024.
En ese sentido, se refirieron específicamente a tres medicamentos, uno de los cuales está en riesgo de desabastecimiento, otro no se encuentra en el mercado disponible (desabastecido) y un tercero se encuentra en proceso de monitorización (aprobación).
-Lamivudina solución oral 10 mg/ml en riesgo de desabastecimiento debido a que hay insuficientes oferentes. (Titulares con registro sanitario vigente: Humax Pharmaceutical (100% de participación en el mercado), Aurobindo Pharma y Hetero Labs).
-Nevirapina suspensión oral 50 mg (5 ml (10mg/ml), desabastecido debido a baja rentabilidad y escasez de materia prima. . (Titular con registro sanitario vigente: Aurobindo Pharma) sin comercialización
–Zidovudina suspensión oral 10mg/ml, en monitorización. Escasez de materia prima. (Titulares con registro sanitario vigente: Humax Pharmaceutical (53 % de participación en el mercado y Hetero Labs con el 47 % de participación en el mercado).
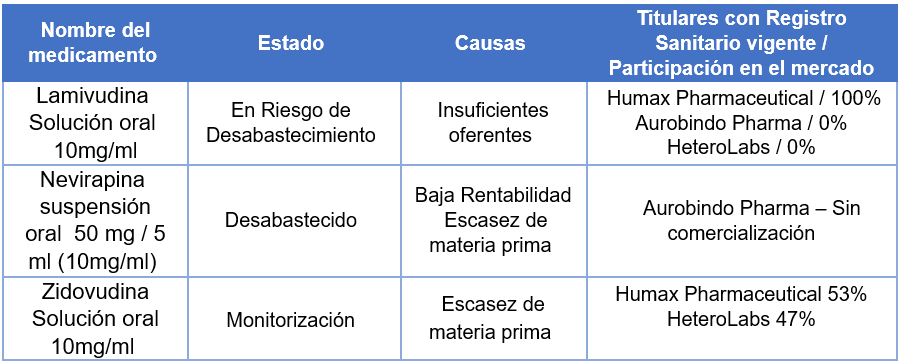
Lamivudina solución oral
En relación con la Lamivudina solución oral, según el MinSalud y el Invima,en los últimos 20 años, se contaban con 12 registros sanitarios para comercializar este medicamento, pero desde el año 2016 empezó a verse la salida de titulares de registro sanitario ya sea por el vencimiento de sus registros sanitarios o la solicitud de pérdida de fuerza ejecutoria.
“De acuerdo con esto, se observa una pérdida de interés en el tiempo por parte de los fabricantes para su comercialización”, señalaron.
Añadieron que “a la fecha, solamente existen tres registros sanitarios vigentes de este medicamento y se identifica desde Invima un (1) trámite pendiente por evacuar, que fue priorizado para ser evaluado en un plazo máximo de 5 días”.
“Adicionalmente, al revisar el reporte de comercialización en SISMED con corte a 30 de septiembre de 2023, se observa una disminución de las unidades mensuales comercializadas debido a interrupciones de comercialización por parte de los titulares de registro sanitario”, enfatizaron.
El Ministerio de Salud señaló que “se estableció comunicación con el único titular de registro sanitario que está comercializando el producto (HUMAX), quien manifestó que contará con disponibilidad del producto a partir del 23 de enero de 2024; con lo cual, se espera la normalización del abastecimiento”.
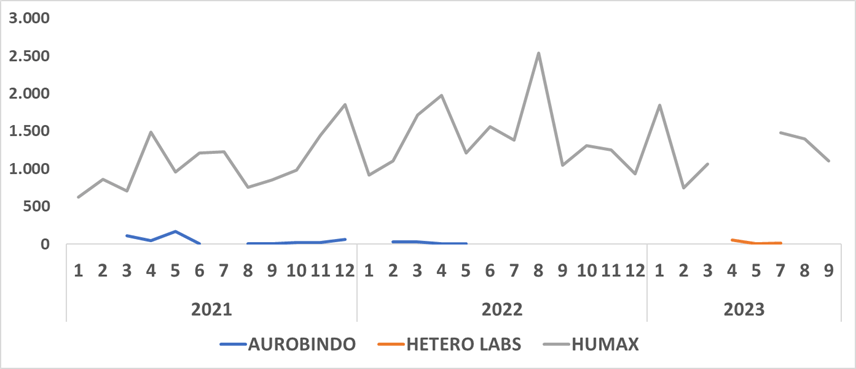
Zidovudina solución oral
Sobre este medicamento, señalaron que durante las últimas dos décadas se contaban con 12 registros sanitarios, no obstante, desde el año 2012 se dio la salida de forma progresiva de la mayoría de estos titulares de registro sanitario en el mercado tanto por el vencimiento de sus registros sanitarios o la solicitud de pérdida de fuerza ejecutoria
“Actualmente, dos registros sanitarios continúan vigentes y se identifica en el Invima un (1) trámite pendiente por evacuar radicado en el 2023, que no afecta la comercialización del producto y que fue priorizado para ser resuelto en un plazo máximo de 5 días”, indicaron.
Agregaron que “al revisar los reportes en el SISMED con corte a 30 de septiembre, se observa una disminución de las unidades mensuales comercializadas debido a la interrupción de la comercialización desde el segundo trimestre del año 2023, por parte del titular de registro sanitario HUMAX, quien manifestó tener escasez de materia prima”.
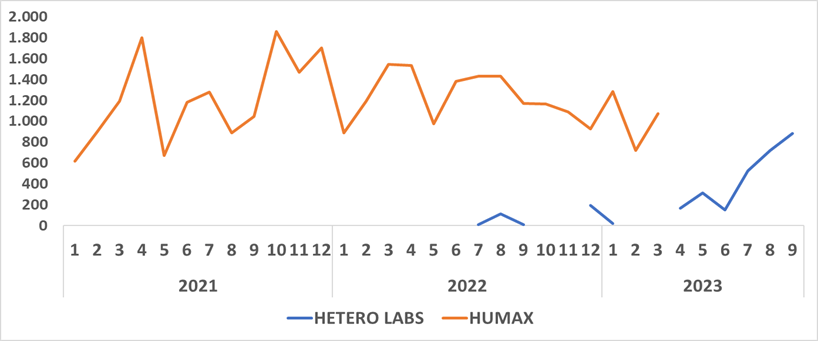
“No obstante, parte de la demanda fue cubierta durante el tercer trimestre del año 2023 por HETEROLABS”, indicaron.
El Ministerio de Salud indicó que estableció comunicación con los dos titulares autorizados para la comercialización, HUMAX que manifestó que a partir del 23 de enero de 2024 contará con unidades disponibles, confirmando que ya supero los problemas de disponibilidad de materia prima que se había presentado semanas atrás.
“Respecto a HETEROLABS, con corte a 15 de enero de 2024, se está a la espera de la confirmación de las cantidades disponibles por parte de este titular de registro sanitario”, indicó.
Neviparina suspensión oral
Según MinSalud y el Invima, revisada la base de registros sanitarios de Invima, durante los últimos 20 años se contaban con cuatro titulares de registro sanitario autorizados para la comercialización de este medicamento en el país, los cuales empezaron a salir del mercado desde el año 2018, quedando solo el registro de AUROBINDO para la comercialización, el cual se encuentra vigente y no se identifican en Invima trámites pendientes por evacuar.
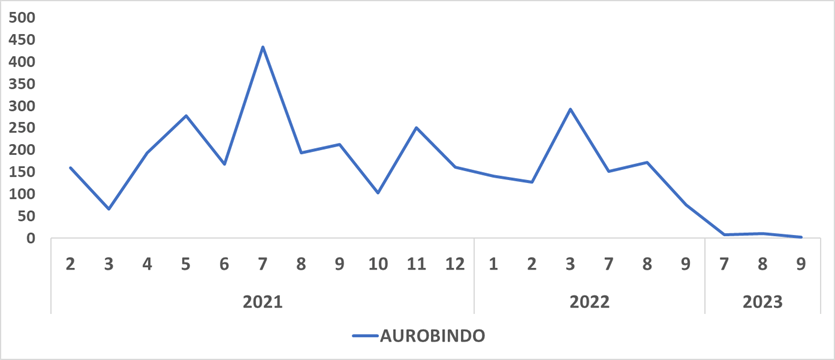
Igualmente, señalaron que “al verificar la información reportada en el SISMED, se observa una notoria reducción de las unidades comercializadas desde agosto del año 2022 por parte del único titular de registro sanitario (AUROBINDO)”.
Petición al Invima
Debido a esta situación el Ministerio de Salud solicitó al Invima la inclusión en el listado de medicamentos vitales no disponibles del 28 de diciembre de 2023, de la Nevirapina.
Señaló que teniendo en cuenta que esta sola o en combinación con otros agentes, “es el medicamento indicado para la profilaxis en neonatos expuestos por vía materno infantil, así como en los esquemas de inicio de tratamiento antirretroviral en niñas y niños menores de 18 meses de edad”.
“Actualmente, se encuentra a la espera la revisión y emisión del concepto de la Sala Especializada de Medicamentos de la Comisión Revisora del Invima para su inclusión en el Listado de Medicamentos Vitales No Disponibles”, indicó.

El Artículo 4 del Decreto 481 de 2004, establece que se podrá realizar su importación bajo la modalidad de «paciente especifico» o «urgencia clínica».
Señaló que un paciente o una persona natural o jurídica pública o privada legalmente constituida, podrá hacer la solicitud ante el Invima.
Para ello se deben presentando los siguientes documentos:
-Solicitud expresa de la autorización de importación presentada ante el Invima.
-Nombre completo del paciente y su documento de identidad.
-Principio activo en su denominación genérica y composición del medicamento.
-Fórmula médica y resumen de la historia clínica en donde se indique la dosis, tiempo de duración del tratamiento, nombre del medicamento y cantidad, la cual debe estar firmada por el médico tratante, con indicación y número de su tarjeta profesional.
-Copia del recibo de consignación correspondiente.
Finalmente, el Ministerio de Salud señaló que un importador también podrá actuar como solicitante de la autorización de importación, registrándose de esta manera como solicitante/importador.
“Las Empresas Administradoras Entidades Administradoras de Planes de Beneficios de Salud (EAPB), gestores farmacéuticos, operadores logísticos de medicamentos o Instituciones Prestadoras de Servicios de Salud (IPS), podrán realizar la contratación con estos importadores para la compra de un medicamento adquirido bajo el modelo de Vital No Disponible”, señaló.
Los invitamos a seguir el canal de SinCandado en WhatsApp. Activen la campanita. https://whatsapp.com/channel/0029Va5h18bL2ATvVS9cpQ1S
Nos encuentran en Twitter en @candado_sin y en Instagram en @sincandadocom

















































Deja un comentario